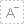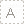按照《干细胞临床研究管理办法(试行)》及国家卫生健康委、国家药品监督管理局关于干细胞临床研究机构备案和项目备案的统一部署,截至目前,北京地区共12家机构通过国家干细胞临床研究机构备案,3个项目通过国家干细胞临床研究项目备案。
|
序号 |
机构名称 |
批次 |
|
1 |
中国医学科学院北京协和医院 |
首批 |
|
2 |
中日友好医院 |
首批 |
|
3 |
中国医学科学院阜外医院 |
首批 |
|
4 |
北京大学人民医院 |
首批 |
|
5 |
北京大学第三医院 |
首批 |
|
6 |
北京大学口腔医院 |
首批 |
|
7 |
北京医院 |
二批 |
|
8 |
首都医科大学附属北京口腔医院 |
二批 |
|
9 |
首都医科大学宣武医院 |
二批 |
|
10 |
首都医科大学附属北京天坛医院 |
二批 |
|
11 |
首都医科大学附属北京同仁医院 |
二批 |
|
12 |
首都医科大学附属北京安贞医院 |
二批 |
根据国家相关规定,北京行政区域内,除已有规定的、未经体外处理的造血干细胞移植及按药品申报的干细胞临床试验外,干细胞治疗相关技术按照临床研究进行管理。拟开展干细胞临床研究的机构,应当按照国家《干细胞临床研究管理办法(试行)》的规定进行机构备案。目前,国家公告两批干细胞临床研究机构名单,北京地区共12家机构成功备案。
|
序号 |
项目名称 |
领域 |
备案机构 |
|
1 |
自体骨髓“间充质干细胞心梗注射液”移植治疗急性心肌梗死的随机、双盲、安慰剂对照、多中心临床试验 |
心血管内科 |
中国医学科学院 阜外医院 |
|
2 |
随机、阳性对照试验评估人脐带间充质干细胞注射液治疗中重度斑块型银屑病患者的有效性和安全性研究 |
皮肤科 |
北京大学第三医院 |
|
3 |
人胚胎干细胞来源的视网膜色素上皮细胞治疗干性老年黄斑变性 |
眼科 |
首都医科大学附属北京同仁医院 |
干细胞临床研究项目应当在已备案的机构实施,并且按照《干细胞临床管理办法》规定,履行干细胞临床研究项目的备案程序。截至目前,北京地区共3项干细胞临床研究项目符合备案条件,顺利通过国家干细胞临床研究项目备案。
干细胞临床研究机构是干细胞制剂和临床研究质量管理的责任主体,要对干细胞制剂制备和临床研究全过程进行质量管理和风险管控。干细胞临床研究必须遵循科学、规范、公开、符合伦理、充分保护受试者权益的原则。临床研究完成后不得进入临床应用。北京市卫生计生委将会同北京市食品药品监管局对备案机构及备案项目进行定期督查、随机抽查、有因检查,促进干细胞临床研究规范进行。