揭示微生物-代谢物轴在衰老中的关键作用
2025年11月27日,北京大学第三医院药物临床试验机构刘东阳研究员团队和北京大学基础医学院郑乐民教授团队合作,在Nature Communications(《自然—通讯》)上发表题为“Odoribacter splanchnicus rescues aging-related intestinal P-glycoprotein damage via GDP-L-fucose secretion”( 内脏臭气杆菌分泌GDP-L-岩藻糖修复衰老肠道P-糖蛋白损伤)的研究论文。

论文截图
该研究系统揭示了肠道微生物通过其代谢产物调控宿主药物外排转运蛋白P-糖蛋白(P-glycoprotein,
P-gp)的新型分子机制,为改善老年人群药物代谢异常及预防药物不良反应提供了潜在的干预靶点与策略。
P-糖蛋白(P-glycoprotein, P-gp/ABCB1)是定位于肠道上皮细胞顶膜的关键ATP依赖性外排转运蛋白,可有效限制多种临床常用药物(如直接口服抗凝药DOACs、地高辛等)的肠道吸收,从而影响其生物利用度。
随着年龄增长,肠道P-gp的表达与功能显著下降,导致药物系统暴露量升高,进而增加老年人群发生药物不良反应的风险。
肠道菌群已被证实参与调控宿主药物代谢与转运过程,但其在衰老背景下对P-gp表达及功能的具体调节机制尚不明确。
研究团队发现,健康人肠道菌群与肠道P-gp表达密切相关;在老年人群及老龄小鼠中,肠道P-gp表达与功能显著降低,且个体差异显著,提示该变化可能受到微生物等可干预因素的调控。
本研究主要创新亮点包括:
揭示因果链条:通过整合转录组、代谢组及16S/宏基因组分析,研究锁定在衰老过程中显著减少的肠道菌—O. splanchnicus。研究团队进一步在抗生素处理及粪菌移植小鼠模型中证实,该菌的干预可有效诱导肠道P-gp表达。
阐明代谢物作用机制:研究阐明,O. splanchnicus通过其编码的GMDS/TSTA3合成代谢物GDP-L-岩藻糖,进而激活eIF4E/c-Jun信号通路,恢复肠道P-gp的表达。外源补充O. splanchnicus或GDP-L-岩藻糖,可在衰老模型中逆转肠道P-gp功能损伤。
明确药动学与临床价值:队列回顾与模型分析表明,在≥75岁的高龄人群中,P-gp功能降低与口服药物系统暴露升高及个体变异增大密切相关,提示通过微生物或代谢物干预,有望降低老年患者使用抗凝药等高风险药物的不良反应。
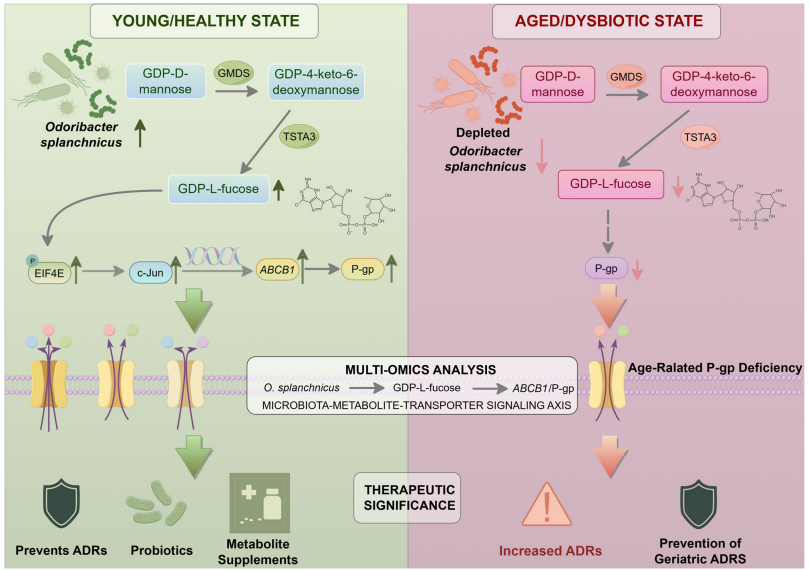
“微生物-代谢物-转运体”轴模式图
研究率先构建以生理药动学模型为基础的“中国老年药动学虚拟人”平台,系统揭示了时序年龄、炎症因子和衰弱指数等生物学年龄对药物代谢和转运过程的显著影响,是导致老年患者药物暴露异质性高的关键因素,研究已实现从“群体平均”向“老年亚群”精准预测的跨越,其成果为我国临床试验指导原则与国际共识提供了依据。两个团队合作,进一步发现了“微生物-代谢物-转运体”轴可逆转衰老相关的肠道P-gp损伤。
这项研究成果不仅深化了对宿主-微生物代谢互作机制的理解,也为改善老年人群药物代谢稳态提供了具有转化潜力的干预靶点。
北京大学第三医院刘东阳研究员和北京大学基础医学院郑乐民教授为本文共同通讯作者,北京大学第三医院崔诚副研究员、北医基础医学八年制毕业生房璐、北京大学第三医院心血管内科李蕾主任医师为共同第一作者。研究获得国家及北京市多项科研基金支持。